Un nuovo coronavirus umano che ora è chiamato grave sindrome respiratoria acuta coronavirus 2 (SARS-CoV-2) (precedentemente chiamato HCoV-19) è emerso a Wuhan, in Cina, alla fine del 2019 e ora sta causando una pandemia.1 Abbiamo analizzato l’aerosol e stabilità superficiale di SARS-CoV-2 e confrontato con SARS-CoV-1, il coronavirus umano più strettamente correlato.2
Abbiamo valutato la stabilità di SARS-CoV-2 e SARS-CoV-1 negli aerosol e su varie superfici e abbiamo stimato le loro percentuali di decadimento usando un modello di regressione bayesiana (vedere la sezione Metodi nell’Appendice Supplementare, disponibile con il testo completo di questa lettera su NEJM.org).
SARS-CoV-2 nCoV-WA1-2020 (MN985325.1) e SARS-CoV-1 Tor2 (AY274119.3) sono stati i ceppi utilizzati.
Gli aerosol (<5 μm) contenenti SARS-CoV-2 (105,25 dose infettiva di coltura tissutale del 50% [TCID50] per millilitro) o SARS-CoV-1 (106,75-7,00 TCID50 per millilitro) sono stati generati con l’uso di un tre- nebulizzatore Jet Collison e immesso in un tamburo Goldberg per creare un ambiente aerosol.
L’inoculo ha prodotto valori di soglia del ciclo tra 20 e 22, simili a quelli osservati nei campioni ottenuti dal tratto respiratorio superiore e inferiore nell’uomo.
I nostri dati consistevano in 10 condizioni sperimentali che coinvolgono due virus (SARS-CoV-2 e SARS-CoV-1) in cinque condizioni ambientali (aerosol, plastica, acciaio inossidabile, rame e cartone). Tutte le misurazioni sperimentali sono riportate come mezzo su tre replicati.
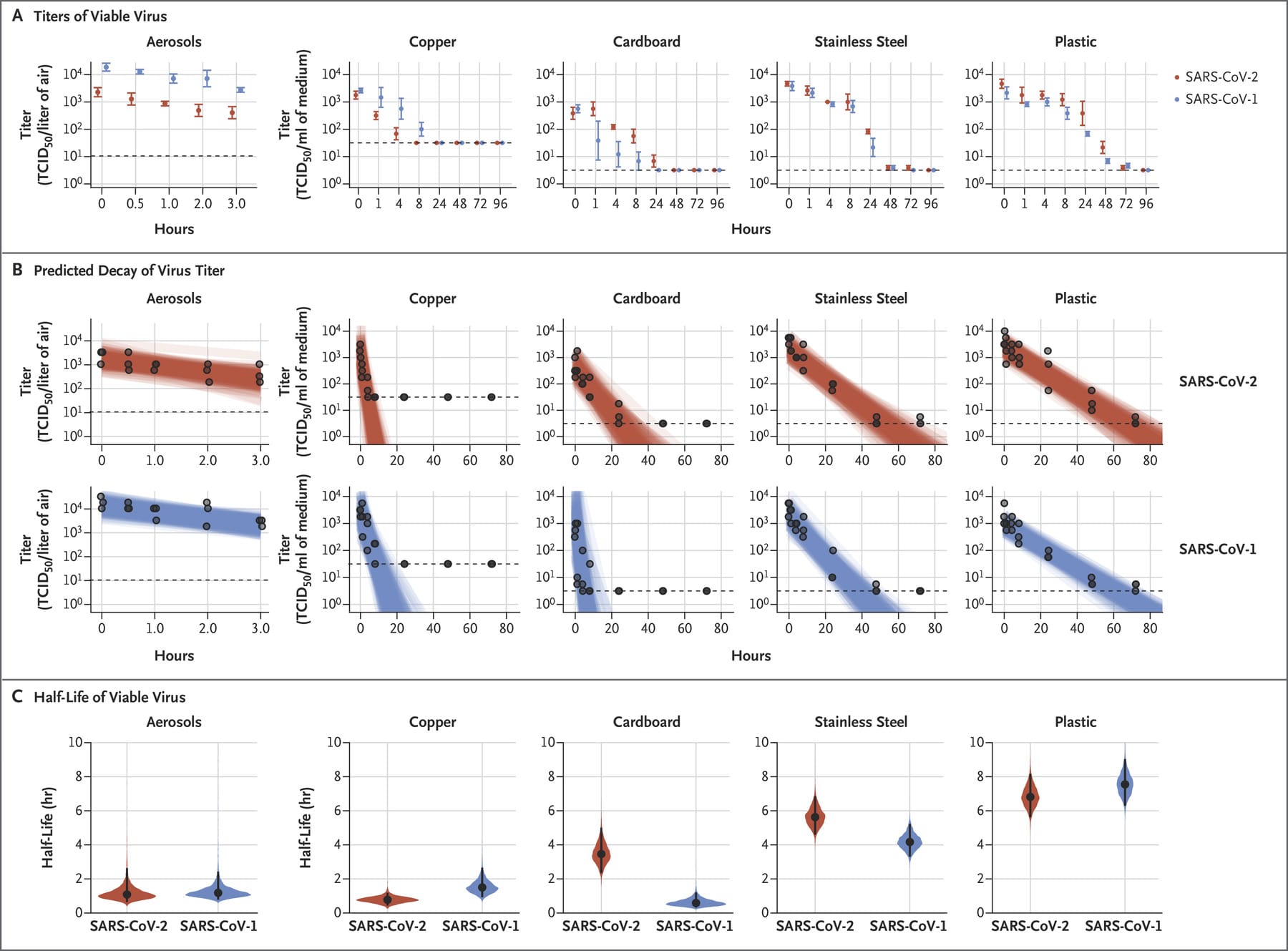
SARS-CoV-2 è rimasto praticabile negli aerosol per tutta la durata del nostro esperimento (3 ore), con una riduzione del titolo infettivo da 103,5 a 102,7 TCID50 per litro di aria. Questa riduzione era simile a quella osservata con SARS-CoV-1, da 104,3 a 103,5 TCID50 per millilitro (Figura 1A).
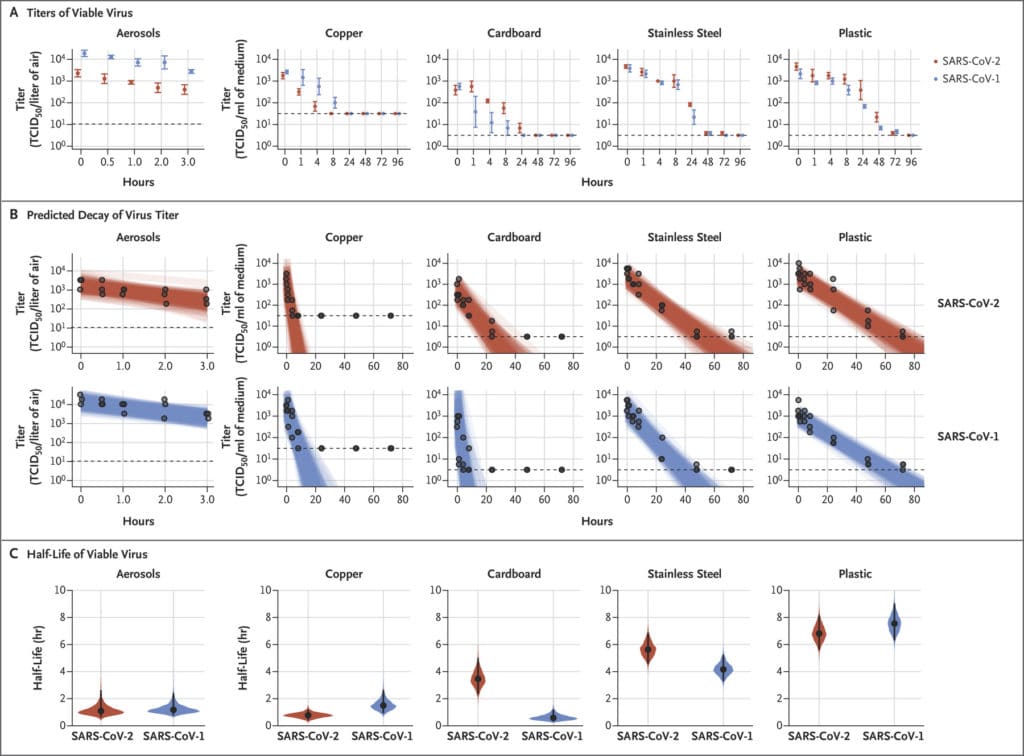
SARS-CoV-2 era più stabile su plastica e acciaio inossidabile rispetto a rame e cartone e il virus vitale è stato rilevato fino a 72 ore dopo l’applicazione su queste superfici (Figura 1A), sebbene il titolo del virus fosse notevolmente ridotto (da 103,7 a 100,6 TCID50 per millilitro di mezzo dopo 72 ore su plastica e da 103,7 a 100,6 TCID50 per millilitro dopo 48 ore su acciaio inossidabile). La cinetica di stabilità di SARS-CoV-1 era simile (da 103,4 a 100,7 TCID50 per millilitro dopo 72 ore su plastica e da 103,6 a 100,6 TCID50 per millilitro dopo 48 ore su acciaio inossidabile). Sul rame, nessuna SARS-CoV-2 vitale è stata misurata dopo 4 ore e nessuna SARS-CoV-1 vitale è stata misurata dopo 8 ore. Su cartone, nessuna SARS-CoV-2 vitale è stata misurata dopo 24 ore e nessuna SARS-CoV-1 vitale è stata misurata dopo 8 ore (Figura 1A).
Entrambi i virus hanno avuto un decadimento esponenziale del titolo del virus in tutte le condizioni sperimentali, come indicato da una diminuzione lineare del log10TCID50 per litro di aria o millilitro di mezzo nel tempo (Figura 1B). Le emivite di SARS-CoV-2 e SARS-CoV-1 erano simili negli aerosol, con stime mediane di circa 1,1 a 1,2 ore e intervalli credibili del 95% da 0,64 a 2,64 per SARS-CoV-2 e da 0,78 a 2,43 per SARS-CoV-1 (Figura 1C e Tabella S1 nell’Appendice supplementare). Anche le emivite dei due virus erano simili sul rame. Sul cartone, l’emivita di SARS-CoV-2 era più lunga di quella di SARS-CoV-1. La vitalità più lunga di entrambi i virus era su acciaio inossidabile e plastica; l’emivita mediana stimata di SARS-CoV-2 era di circa 5,6 ore su acciaio inossidabile e 6,8 ore su plastica (Figura 1C). Le differenze stimate nelle emivite dei due virus erano piccole tranne quelle su cartone (Figura 1C). I dati dei singoli replicati erano notevolmente più “rumorosi” (ovvero, c’erano più variazioni nell’esperimento, risultando in un errore standard più grande) per il cartone rispetto ad altre superfici (da Fig. S1 a S5), quindi si consiglia cautela nell’interpretazione di questo risultato.
Abbiamo scoperto che la stabilità di SARS-CoV-2 era simile a quella di SARS-CoV-1 nelle circostanze sperimentali testate. Ciò indica che le differenze nelle caratteristiche epidemiologiche di questi virus probabilmente derivano da altri fattori, tra cui elevate cariche virali nel tratto respiratorio superiore e il potenziale per le persone infette da SARS-CoV-2 di liberarsi e trasmettere il virus mentre sono asintomatici. 3,4 I nostri risultati indicano che la trasmissione di aerosol e fomiti di SARS-CoV-2 è plausibile, poiché il virus può rimanere vitale e infettivo negli aerosol per ore e su superfici fino a giorni (a seconda del capannone dell’inoculo). Questi risultati fanno eco a quelli con SARS-CoV-1, in cui queste forme di trasmissione erano associate a eventi nosocomiali di diffusione e super-diffusione 5 e forniscono informazioni per gli sforzi di mitigazione della pandemia.
Autori dello studio:
Neeltje van Doremalen, Ph.D.
Trenton Bushmaker, B.Sc.
National Institute of Allergy and Infectious Diseases, Hamilton, MT
Dylan H. Morris, M.Phil.
Princeton University, Princeton, NJ
Myndi G. Holbrook, B.Sc.
National Institute of Allergy and Infectious Diseases, Hamilton, MT
Amandine Gamble, Ph.D.
University of California, Los Angeles, Los Angeles, CA
Brandi N. Williamson, M.P.H.
National Institute of Allergy and Infectious Diseases, Hamilton, MT
Azaibi Tamin, Ph.D.
Jennifer L. Harcourt, Ph.D.
Natalie J. Thornburg, Ph.D.
Susan I. Gerber, M.D.
Centers for Disease Control and Prevention, Atlanta, GA
James O. Lloyd-Smith, Ph.D.
University of California, Los Angeles, Los Angeles, CA, Bethesda, MD
Emmie de Wit, Ph.D.
Vincent J. Munster, Ph.D.
National Institute of Allergy and Infectious Diseases, Hamilton, MT
vincent.munster@nih.gov
Supported by the Intramural Research Program of the National Institute of Allergy and Infectious Diseases, National Institutes of Health, and by contracts from the Defense Advanced Research Projects Agency (DARPA PREEMPT No. D18AC00031, to Drs. Lloyd-Smith and Gamble), from the National Science Foundation (DEB-1557022, to Dr. Lloyd-Smith), and from the Strategic Environmental Research and Development Program of the Department of Defense (SERDP, RC-2635, to Dr. Lloyd-Smith).
I risultati e le conclusioni in questa lettera sono quelli degli autori e non rappresentano necessariamente la posizione ufficiale dei Centers for Disease Control and Prevention (CDC). I nomi di specifici fornitori, produttori o prodotti sono inclusi per scopi di informazione e salute pubblica; l’inclusione non implica l’approvazione di venditori, produttori o prodotti da parte del CDC o del Dipartimento della salute e dei servizi umani.
Questa lettera è stata pubblicata il 17 marzo 2020 su NEJM.org.